Разные твердые материалы имеют разную температуру плавления из-за различий в их атомной структуре и связях между атомами. Вещества с сильными ковалентными или ионными связями, например, алмазы или соли, требуют большей энергии для разрушения этих связей, что приводит к высоким значениям температуры плавления.
Кроме того, организация атомов в кристаллической решетке также влияет на плавление. Некоторые материалы могут иметь более слабые межмолекулярные силы или аморфную структуру, что делает их менее устойчивыми к теплу и, как следствие, приводит к более низкой температуре плавления.
Какие факторы влияют на температуру плавления?
Температура плавления — это значение, при котором твердое вещество становится жидким. В принципе, температура плавления твердого объекта совпадает с температурой замерзания жидкости — момента, когда она конвертируется в твердое состояние. Например, лед — это замороженная вода, которая тает при 0 градусах Цельсия / 32 градуса по Фаренгейту и становится жидкой. Вода замерзает при той же температуре и превращается в лед. Твердые вещества сложно нагревать до значений выше их точек плавления, поэтому определение температуры плавления эффективный способ определения вещества.
Молекулярный состав, сила притяжения и наличие примесей могут оказывать влияние на температуру плавления веществ.
Состав молекул
Когда молекулы тесно упакованы, вещество обладает более высокой температурой плавления по сравнению с веществом, в котором молекулы упакованы менее плотно. Например, у симметричных молекул неопентана температура плавления выше, чем у изопентана, у которого молекулы упакованы менее плотно. Также молекулярный размер оказывает влияние на температуру плавления. При равных остальных условиях, меньшие молекулы плавятся при более низких температурах, чем более крупные. Например, температура плавления этанола составляет -114,1 градус по Цельсию / -173,4 градуса по Фаренгейту, в то время как температура плавления более крупной молекулы этилцеллюлозы составляет 151 градус по Цельсию / 303,8 градуса по Фаренгейту.
Полимеры обладают огромными структурами, состоящими из множества неметаллических атомов, связанных с соседними атомами ковалентными связями. Материалы с гигантскими ковалентными структурами, такие как алмаз, графит и диоксид кремния, обладают чрезвычайно высокими температурами плавления, потому что несколько крепких ковалентных связей должны быть разрушены, прежде чем они смогут расплавиться.
Механизм плавления твердого тела
Процесс превращения твердого вещества в жидкость можно пояснить изменением энергетического состояния твердого тела при его нагревании. При добавлении тепла к кристаллическому веществу увеличивается энергия (амплитуда) колебаний его атомов, что приводит к повышению температуры и способствует возникновению различных дефектов в кристалле. Постепенное увеличение числа дефектов и их накопление характеризуют стадию "предплавления" (рис. 4.4.). При достижении температуры плавления в кристалле достигается критическая концентрация дефектов.
Начинается процесс плавления, в результате которого кристаллическая решетка распадается на микроскопические частицы. Тепло, подаваемое в этот момент, не приводит к нагреву тела, а используется для разрыва межатомных связей и нарушения порядка в кристалле. После завершения этого процесса твердое тело полностью превращается в жидкость. Температура, при которой происходит это явление, называется температурой плавления.
С точки зрения термодинамики, при температуре плавления достигается равновесное состояние, когда энергии Гиббса твердой и жидкой фаз выравниваются.
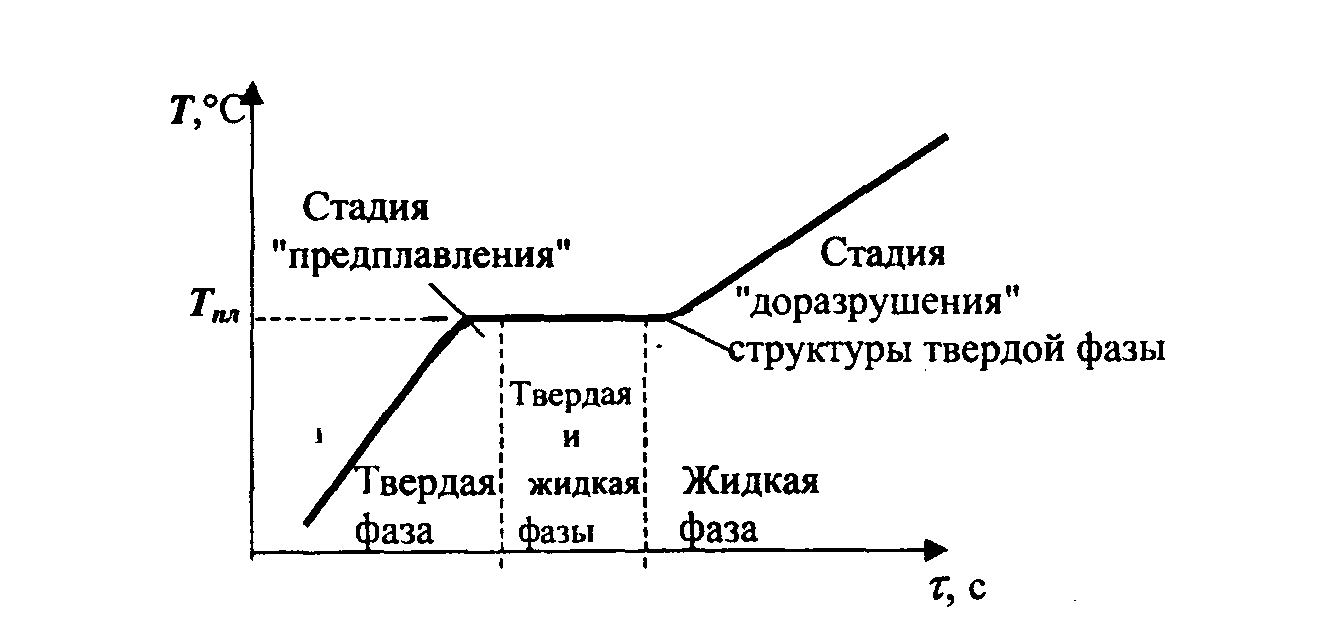
Начертание 4.4. Фазовые изменения от твердого тела к жидкости в процессе
При нормальных условиях, без учета сверхвысоких давлений, которые Влияют на Тт, следует рассматривать температуру плавления как одну из характеристических констант вещества.
Состав и температура плавления
Из-за того, что строительное материаловедение в основном изучает поликристаллические материалы и сложные кристаллы, вызывает интерес влияние составляющих компонентов на их температуру плавления.
Этот эффект представляет собой множественный и чрезвычайно сложный, так как при нагревании и плавлении даже самой простой двухкомпонентной системы необходимо рассматривать следующие возможные варианты:
— сохранение состава при фазовом переходе (конгруэнтное плавление);
— образование нового соединения (инконгруэнтное плавление);
— образование твердых растворов, то есть изоморфных смесей смешанных кристаллов;
— проявление полиморфизма одним или всеми компонентами.
Температура плавления
Известие о температуре плавления обозначает точку, в которой твердое вещество переходит в жидкое. У каждого вещества своя уникальная температура плавления, зависящая от его химического состава и структуры.
Температура плавления представляет собой важное свойство для вещества, так как определяет условия перехода из твердого в жидкое состояние. Это свойство находит широкое применение в промышленности, научных исследованиях и бытовых нуждах.
Измерение температуры плавления может осуществляться различными методами, в том числе с использованием термометров, пирометров или специализированных устройств, регистрирующих изменение физических свойств вещества при нагревании.
Понимание точки плавления материала играет важную роль в управлении и улучшении процессов плавления в производстве. Например, в промышленности металлов и сплавов, знание конкретной точки плавления позволяет определить оптимальные параметры для производства высококачественной продукции.
Фазовые переходы при плавлении
Процесс изменения состояния вещества происходит при нагревании до его температуры плавления и называется фазовыми переходами. Эти процессы могут происходить по-разному, в зависимости от типа вещества и условий.
Твердое состояние
Первоначальное состояние вещества до таяния — состояние твердого тела. В этом состоянии молекулы или атомы вещества организованы в определенной структуре и обладают низкой энергией. Твердое тело имеет конкретную форму и объем.
Когда вещество нагревается до температуры плавления, происходит переход из твердого в жидкое состояние. В этот момент молекулы или атомы вещества начинают двигаться быстрее, что разрушает их упорядоченную структуру. В результате материал становится жидким, не имеет определенной формы, но сохраняет свой объем.
Жидкое состояние
Когда молекулы или атомы вещества находятся в жидком состоянии, они свободно двигаются, но все еще остаются расположенными достаточно близко друг к другу. Жидкость имеет определенный объем, но не имеет определенной формы и принимает форму сосуда, в котором она находится.
Кристаллизация
Когда жидкое вещество охлаждается до температуры кристаллизации, происходит обратный фазовый переход — кристаллизация. В этот момент молекулы или атомы вещества начинают упорядочиваться и образуют кристаллическую структуру, делая вещество твердым и придают ему определенную форму и объем.
Фазовые переходы во время плавления играют важную роль в различных отраслях, включая промышленность, научные исследования и повседневную жизнь. Понимание этих переходов позволяет контролировать и улучшать процессы плавления в промышленности, а также разрабатывать новые материалы и технологии.
Теплота сгорания
Количество теплоты, выделяющейся при полном сгорании топлива, называется теплотой сгорания или теплотворной способностью.
Энергия, выделяющаяся при сгорании топлива, часто используется для нагревания тел. Обычные виды топлива, такие как уголь, нефть и бензин, содержат углерод. При горении углерод соединяется с кислородом из воздуха, образуя углекислый газ и увеличивая кинетическую энергию молекул.
Увеличение кинетической энергии молекул в процессе горения называется выделением энергии и именно это является теплотой сгорания топлива.
Теплота сгорания зависит от вида топлива и его массы. Чем больше масса топлива, тем больше количество выделяющейся теплоты при полном сгорании.
Удельная теплота сгорания топлива — это физическая величина, которая показывает, сколько теплоты выделяется при полном сгорании 1 кг топлива. Обозначается она буквой q и измеряется в джоулях на килограмм (Дж/кг).
Количество теплоты Q, которое выделяется при сгорании m кг топлива, можно вычислить по специальной формуле.
Для определения количества теплоты, выделяющегося при полном сгорании топлива определенной массы, нужно умножить удельную теплоту сгорания этого топлива на его массу.
Каждый человек способен легко различить тела на твёрдые и жидкие. Однако такое разделение основано исключительно на внешних характеристиках. Для того, чтобы установить, какими свойствами обладают твёрдые тела, мы будем их нагревать. Некоторые тела загорятся (дерево, уголь) — это органические вещества. Другие станут мягкими (смола) даже при низких температурах — это аморфные вещества.
Особую категорию твёрдых тел составляют те, зависимость температуры от времени нагревания которых показана на рисунке 12. Это именно кристаллические вещества. Поведение кристаллических тел при нагревании обусловлено их внутренним строением.
Кристаллические объекты — это те, у которых атомы и молекулы упорядочены и этот порядок сохраняется на больших расстояниях. Пространственное периодическое распределение атомов или ионов в кристалле называется кристаллической решеткой. Точки кристаллической решетки, в которых расположены атомы или ионы, называются узлами кристаллической решетки.
Кристаллические объекты делятся на монокристаллы и поликристаллы. Монокристалл имеет однородную кристаллическую решетку во всем объеме.
Анизотропия у монокристаллов проявляется в зависимости их физических свойств от направления. Поликристалл представляет собой совокупность мелких, по-разному ориентированных монокристаллов (зерен) и не обладает анизотропией свойств. Большинство твердых тел имеют поликристаллическую структуру (минералы, сплавы, керамика).
Основные характеристики кристаллических тел включают: точную температуру плавления, упругость, прочность и зависимость свойств от порядка расположения атомов в кристаллической решетке.
Аморфными называют вещества, у которых нет порядка в расположении атомов и молекул во всем объеме. В отличие от кристаллических веществ, аморфные вещества изотропны, что означает, что их свойства одинаковы во всех направлениях. Переход от аморфного к жидкому состоянию происходит постепенно, не имея четко определенной температуры плавления. Аморфные тела не обладают упругостью и являются пластичными. В аморфном состоянии находятся различные вещества, такие как стекло, смолы, пластмассы и другие.
Упругость — это способность тела восстановить свою форму и объем после прекращения воздействия внешних сил или других факторов, приводящих к его деформации. Согласно закону Гука, упругие деформации пропорциональны воздействующим на них внешним силам. Формула для упругой деформации растяжения-сжатия: 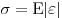 , где
, где 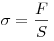 — механическое напряжение,
— механическое напряжение, 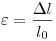 — относительное удлинение,
— относительное удлинение, 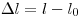 — абсолютное удлинение,
— абсолютное удлинение, 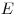 — модуль Юнга (модуль упругости). Упругость обусловлена взаимодействием и тепловым движением частиц, из которых состоит вещество.
— модуль Юнга (модуль упругости). Упругость обусловлена взаимодействием и тепловым движением частиц, из которых состоит вещество.
Пластичность — это способность прочных тел изменять свою форму и размеры под воздействием внешних сил, не разрушаясь, и сохранять остаточные деформации после прекращения воздействия этих сил. Такие деформации называются пластическими.
Как на графике выглядит процесс кристаллизации для кристаллического тела
Давайте сейчас прекратим нагревание воды, вынесем кастрюльку на улицу в мороз и оставим ее там на какое-то время. Вода начнет охлаждаться, ее температура будет снижаться. На рисунке 4 это изображено убывающей до нуля наклонной синей линией.
Рис. 4. Процесс кристаллизации – это горизонтальная линия на температурном графике
Как только вода охладится до нуля градусов, начнется процесс превращения жидкости в твердое тело – лед. Потому что ноль градусов Цельсия – это температура не только плавления, но и кристаллизации льда. Сначала появятся маленькие кристаллы льда. Этому соответствует левая часть красной горизонтальной линии на графике 4.
Заметки: Если в воде присутствуют пылинки или другие небольшие загрязнения, то кристаллизация происходит быстрее. Такие мелкие примеси называются центрами кристаллизации.
По мере увеличения количества льда, уменьшается количество воды. При этом температура воды и льда в кастрюле остается на уровне нуля градусов Цельсия.
Когда вся вода в кастрюле превращается в лед, это соответствует крайней правой точке на красной линии на графике.
Только после этого температура льда начинает понижаться ниже нуля. На рисунке это показано наклонной синей линией, начинающейся справа от горизонтальной красной линии.
Заметим: для того чтобы перейти из жидкого состояния в твердое (стать кристаллом), вещество должно избавиться от излишка тепловой энергии. Это означает, что при кристаллизации вещество отдает энергию окружающим объектам. Физики называют это процессом "выделения тепловой энергии во внешнюю среду".
- Основные темы
- Физика
- Единицы измерения
- Физические явления
- Астрономия
- Движение
- Равномерное прямолинейное движение
- Равноускоренное движение
- Равномерное движение по окружности
- Путь при неравномерном движении
- Первый закон Ньютона
- Масса и плотность
- Второй и третий законы Ньютона
- Сила упругости
- Сила тяготения
- Сила трения
- Статика твёрдого тела
- Статика жидкостей и газов
- Импульс
- Энергия
- Простые механизмы
- Механические колебания
- Механические волны
- Молекулярная физика
- Основные формулы молекулярной физики
- Температура
- Закон состояния идеального газа
- Процессы с постоянной внутренней энергией
- Пар, находящийся в равновесии с твердым или жидким состоянием
- Энергия, связанная с внутренними свойствами системы
- Количество теплоты, переданное системе
- Изменение состояния вещества между различными агрегатными состояниями
- Закон сохранения энергии для тепловых процессов
- Машины, преобразующие тепловую энергию в механическую работу
- Невозможность превращения теплоты из низших в более высокие формы без дополнительных затрат энергии
- Физическая величина, обозначающая свойство материи взаимодействовать с другими заряженными частицами
- Устройство для хранения электрического заряда
- Постоянное движение электрических зарядов
- Величина, характеризующая зависимость между напряжением и силой тока в цепи
- Сплетение различных материалов для создания электрических контуров
- Произведенная работа или количество энергии, переданной отличной от режима нулевого напряжения цепи
- Сила, создаваемая внутри любого замкнутого контура, поддерживающего постоянный электрический ток
- Движение заряда в материалах, обладающих высокой проводимостью
- Движение заряда в электролите, проводящем ток благодаря своим электрохимическим свойствам
- Движение заряда в газообразных средах
- Материалы, обладающие проводимостью, промежуточной между металлами и диэлектриками
- Зона окружности, около намагниченного тела, по которой возникают силы взаимодействия
- Физические воздействия, создаваемые магнитом
- Возникновение электрического тока в проводнике под воздействием изменяющегося магнитного поля
- Феномен возникновения электрического тока в контуре при изменении потока магнитного поля внутри контура
- Колебания электромагнитного поля, происходящие под действием взаимодействия электрического и магнитного полей
- Электрический ток переменного характера
- Мощность в цепи переменного тока
- Электрическая энергия
- Воздействие электромагнитного поля
- Распространение электромагнитных волн
- Оптический свет. Лучи и их свойства
- Отражение света от поверхностей
- Преломление света в оптических средах
- Формирование изображений при прохождении через линзы
- Формирование изображений при прохождении лучей через тонкие линзы
- Процессы образования изображений в системах с тонкими линзами
- Орган зрения у человека
- Оптические приборы и их функции
- Принцип распространения света по Гюйгенсу
- Интерференция волн в оптике
- Интерференция света и ее характеристики
- Явление дифракции света
- Разложение света на спектральные составляющие
- Принцип относительности в механике по Галилею
- Основные принципы специальной теории относительности
- Кинематика в рамках специальной теории относительности
- Динамика в рамках специальной теории относительности
- Явление фотоэффекта
- Корпускулярно-волновой дуализм фотонов
- Линейчатые спектры и их свойства
- Строение атома и его особенности
- Ёлка
- Сани
- Дед Мороз
- Снегурочка
- Снеговик
- Зимние праздники
Почему у каждого человека свой уникальный отпуск?
Потому что мы все разные, у нас разные интересы
Заметим, что каждый человек проводит отпуск по-своему. Одни предпочитают пляжный отдых, другие — активный туризм, третьи — культурный отдых. Все зависит от личных предпочтений и возможностей. Кто-то предпочитает отдыхать заграницей, а кто-то остается в своём родном городе. Главное, чтобы отпуск приносил удовольствие и позволял отдохнуть от повседневной рутины.
ПОХОЖИЕ ЗАДАНИЯ:
- Сказки Чуковского
- Школьный дневник
- Процессы изобарного расширения
- Количество теплоты в физике
- Изучение насыщенного пара в термодинамике
- Основные принципы молекулярно-кинетической теории
- Формулы, используемые в молекулярной физике
- Закон сохранения энергии в термодинамике
- Изучение понятия температуры в физике
- Принцип работы тепловых машин
- Уравнение состояния идеального газа в физике
- Изучение фазовых переходов в термодинамике
Физика 8 класс. Урок№19. Агрегатные состояния вещества. Плавление и отвердевание кристаллических тел
Вам хорошо известно, что одно и то же вещество может находиться в трех агрегатных состояниях: в твёрдом, жидком и газообразном. Эти состояния вещества отличаются расположением, характером движения и взаимодействия молекул. При определенных условиях, например при определенных значениях температуры и давления, вещества могут переходить из одного агрегатного состояния в другое. Самым известным примером этого являются вода, лед и пар.

Превращения вещества из одного агрегатного состояния в другое называются агрегатными превращениями.
Много природных явлений обусловлены естественным изменением агрегатных состояний различных веществ. Например, широко известный водный круговорот в природе объясняется изменением агрегатного состояния воды.
Конечно, у вас могут возникнуть вопросы: при каких условиях происходит переход вещества из одного агрегатного состояния в другое? Или как объяснить изменение агрегатного состояния вещества?
Давайте попытаемся найти ответы на эти и другие вопросы. Вы уже знаете, что молекулы одного и того же вещества не изменяются при изменении его агрегатного состояния. А меняется их расположение, характер движения и взаимодействия.

Твёрдые тела — это материалы, в которых молекулы плотно упакованы и могут только дрожать на своих местах.
Жидкость — это вещество, в котором молекулы свободно перемещаются, но сохраняют свою форму.
Газ — это состояние вещества, в котором молекулы свободно двигаются и занимают весь доступный объем.
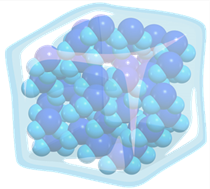
Из-за сильного взаимодействия между частицами в твёрдом веществе и их отсутствия подвижности, твёрдые тела сохраняют свою форму и объём.
В жидкостях молекулы расположены на некотором расстоянии друг от друга, что позволяет им совершать беспорядочные колебания и вращения в пределах своего положения, а также перемещаться относительно друг друга.
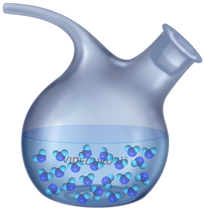
Существование взаимного притяжения между молекулами обеспечивает сохранение объема жидкости и придает ей текучесть.
Молекулы в газах находятся на большом расстоянии друг от друга, поэтому молекула свободно движется до тех пор, пока не столкнется с другой молекулой или стенкой сосуда, в котором она находится.
Если стенки сосуда не препятствуют движению газа, то его молекулы начинают распространяться в разных направлениях.
Рассмотрим несколько примеров того, как люди могут использовать изменение агрегатных состояний веществ для своих целей. Одним из таких устройств является паровая турбина.
Этот двигатель работает за счет разности давлений, которая преобразует энергию пара в механическую энергию.
Также, для того чтобы придать различные формы металлическим изделиям, сначала металлы приводят в жидкое состояние, а затем их остужают.

В частности, применяют сжиженный газ в системах охлаждения.

На прошлом занятии мы обсуждали, что во время теплопередачи изменяется внутренняя энергия тела, зачастую это происходит из-за изменения температуры. В то же время состояние вещества остается неизменным. Однако существуют процессы, в результате которых внутренняя энергия увеличивается, а температура остается постоянной при получении теплоты.
Такие процессы включают в себя плавление и кристаллизацию (отвердевание). Давайте изучим эти явления на практике.
Давайте возьмем калориметр и поместим во внутренний сосуд немного измельченного льда с температурой минус десять градусов Цельсия.
Поместим термометр в калориметр и оставим его на столе. Мы будем следить за изменениями температуры льда и процессами, происходящими с ним. Наши наблюдения показывают, что лед остается в твердом состоянии в течение некоторого времени, а его температура постепенно увеличивается.

Когда температура достигает 0°C, лёд начинает таять, превращаясь в воду, но при этом его собственная температура остаётся постоянной. Это состояние сохранится до тех пор, пока весь лёд не превратится в жидкость. Только после этого температура воды, образовавшейся изо льда, начнёт повышаться. Этот процесс будет продолжаться до тех пор, пока температура не сравняется с комнатной.
Этот процесс перехода вещества из твёрдого состояния в жидкое называется плавлением.
Из проведённых наблюдений можно сделать несколько важных выводов.
Во-первых, лёд начинает таять при определённой температуре. Важно отметить, что лёд находится в кристаллическом состоянии. Следовательно, процесс плавления кристаллических тел происходит при определённой температуре, которую называют температурой плавления.
Во-вторых, во время процесса плавления кристаллического вещества его температура остаётся постоянной, как и температура льда и образовавшейся воды.
Плавление любых кристаллических тел происходит аналогично плавлению льда. Для того чтобы расплавить твёрдое кристаллическое тело, его необходимо нагреть до температуры плавления и далее передавать энергию до полного превращения в жидкость. Исключением являются вещества, меняющие свой химический состав или немедленно переходящие в газовую фазу.
Температура плавления различных кристаллических веществ также различна.
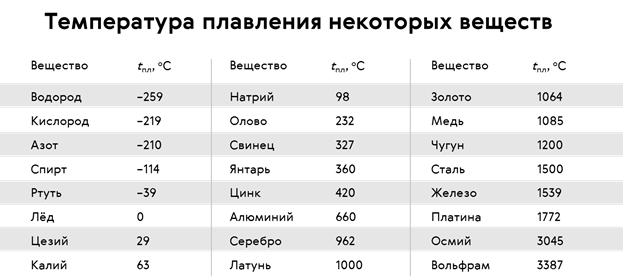
Из представленной таблицы становится ясно, что температуры плавления различных веществ изменяются в широком диапазоне.
Учет температуры плавления необходим при разработке бытовой и промышленной техники. Например, спирали лампочек и нагревательных элементов изготавливаются из тугоплавких материалов. В авиационной и космической промышленности используются материалы с очень высокой температурой плавления.
Вернемся к нашему эксперименту с калориметром. Поместим его с водой в морозильную камеру и проанализируем изменение температуры воды.

Обратим внимание, что сперва вода будет охлаждаться до 0 градусов Цельсия, передавая при этом определенное количество тепла окружающему воздуху. При этом будет уменьшаться её внутренняя энергия за счет уменьшения средней кинетической энергии движения молекул. Когда температура воды достигнет 0 градусов Цельсия, она начнет превращаться в лед. При этом температура воды не будет меняться до тех пор, пока она полностью не превратится в твердое состояние.
Процесс перехода вещества из жидкого состояния в твердое называется отвердеванием или кристаллизацией.
Этот процесс сопровождается выделением определенного количества тепла и, соответственно, уменьшением внутренней энергии вещества за счет уменьшения потенциальной энергии взаимодействия его молекул.
Отвердение или кристаллизация происходит при определенной температуре, которая называется температурой отвердевания или кристаллизации. Эта температура остается неизменной во время процесса кристаллизации.
Эксперименты показывают, что для кристаллических веществ температура кристаллизации равна температуре плавления.
Следует отметить, что понятия «температура плавления» и «температура кристаллизации» не применимы ко всем веществам. Например, нагревая холодный твердый пластилин, мы чувствуем, как его твердость постепенно уменьшается. Продолжая нагревать его, мы можем превратить пластилин в вязкую жидкость.
В дополнение к стеклу и пластилину, можно также упомянуть твёрдую смолу, сургуч, различные виды пластмасс и т. д.
Таким образом, следует помнить, что понятия "температура плавления" и "температура кристаллизации" применимы только к веществам с кристаллической структурой.
Задание на дом
Прочитать страницы с 36 по 40, выполнить упражнение 11 в тетради

Узнайте всё о Турции
Здесь вы сможете познакомиться с культурой, историей, традициями и обычаями этой удивительной страны.


