Название «галогены» происходит от греческих слов «halo» (соль) и «genes» (рождающий), что указывает на способность этих элементов образовывать соли с металлами. Галогены включают фтор, хлор, бром, йод и астат, и они были впервые систематически изучены в XIX веке. Одним из первооткрывателей фтора стал Антуан Лавуазье, а хлор был выделен шведским химиком Карлом Вильгельмом Шееле.
Физические свойства галогенов варьируются от газообразного фтора до твердых веществ, таких как йод, при нормальных условиях. Все галогены обладают высокой электроотрицательностью и способны легко реагировать с металлами, образуя соли, что делает их важными для химической промышленности и исследования.
Презентация к уроку химии (9 класс) по теме: Презентация "Сравнительная характеристика галогенов" — презентация
1 Евгения Андреевна Казанцева, преподаватель химии в МОУ школе 12 с углубленным изучением отдельных предметов в городе Жуковский.
2 Цель данного урока — расширить знания об элементах-аналогах Периодической системы на примере подгруппы галогенов. Для этого ставятся следующие задачи: знакомство с историей открытия галогенов, сравнение строения атомов галогенов с выделением сходств и различий, сравнение физических свойств и химической активности галогенов, а также представление о роли галогенов в организме.
3 В данном уроке предлагается заполнить таблицу по открытию галогенов: указать название галогена, значение названия, дату открытия, имя открывшего ученого и уравнение реакции для каждого из галогенов: фтора, хлора, брома, йода и астата.
Флюор(F 2) — из греческого "фторос" — был открыт в 1866 году французским химиком Анри Муассаном методом электролиза смеси жидкого безводного HF и гидродифторида калия KHF 2 в платиновом сосуде: 2HFH 2 + F 2 катод анод В 1906 году Муассан был удостоен Нобелевской премии за открытие элемента фтора и внедрение в практику электрической печи, названной его именем
Открытие хлора Хлор Cl 2 от греческого "хлороз" — желто-зеленый 1774 год шведским аптекарем Карлом Вильгельмом Шеели. "Я поместил смесь черной магнезии с нуриевой кислотой в реторту, к горлышку которой присоединил пузырь, лишенный воздуха, и поставил ее на песчаную баню. Пузырь наполнился газом, который имел желто-зеленый цвет и пронзительный запах". Уравнение реакции: MnO 2 + 4HCl Cl 2 + MnCl 2 + 2H 2 O
6 Изучение химических свойств брома Бром (Br2) (греч. «бромос» — "зловонный") было проведено французским химиком (24-летним лаборантом) Антуаном-Жеромом Баларом в 1826 году. Он получил бром действием хлора на растворы солей соляных болот Франции по следующей реакции: 2NaBr + Cl2 → 2NaCl + Br2
7 Открытие исследование свойств йода Йод (I2) (греч. «тодес» — "фиолетовый") было выполнено французским химиком-технологом и фармацевтом Бернаром Куртуа в 1811 году. Он получил йод из золы морских водорослей по следующему уравнению реакции: 2NaI + H2SO4 → Na2SO4 + I2
8 Открытие и изучение свойств астата Астат(At2) (греч. «астатос» — "неустойчивый") было проведено в 1940 году искусственным путем при облучении висмута альфа-частицами учеными Калифорнийского университета Д.Корсоном и К.Р.Маккензи
9 При изменении заряда ядра у атомов галогенов происходят следующие изменения: радиус атома увеличивается, количество валентных электронов остается равным 7, притяжение валентных электронов к ядру уменьшается, их способность отдавать электроны увеличивается, неметаллические свойства ослабевают, и окислительная способность уменьшается.
10 Физические свойства простых веществ-галогенов: бром, йод, хлор, астат
11 Возгонка йода: кристаллический йод при нагревании переходит из твердого состояния в газообразное, минуя жидкое состояние, превращаясь в фиолетовые пары. Опыт: возгонка йода пары. йода
12 Сравнение внешних свойств галогенов: F 2 — светло-желтый газ, Cl 2 — желто-зеленый газ, Br 2 — красно-бурая жидкость, I 2 — темно-серые кристаллы с металлическим блеском, At 2 — черно-синие кристаллы. Цвет усиливается, плотность увеличивается, а также увеличиваются температуры плавления и кипения.
13 Химические свойства фтора: Взаимодействует со всеми металлами с выделением большого количества теплоты. Взаимодействует с алюминием: 3F + 2Al = 2AlF3 + 1130 кДж, с железом: 3F2 + 2Fe = 2FeF3 + 720 кДж. При нагревании взаимодействует со многими неметаллами, кроме кислорода, азота и алмаза, а также с водородом: F2 + H2 = 2HF + 538 кДж, с кремнием: 2F2 + Si = 2SiF4 + 634 кДж. Окисляет другие галогены: хлор: F2 + Cl2 = 2ClF, бром: F2 + Br2 = 2BrF, йод: F2 + I2 = 2lF.
14 Фтор обладает высокой химической активностью. При воздействии даже инертных газов происходит реакция: Xe + F2 → XeF. Он Взаимодействует с различными веществами: с водой: 2F2 + 2H2O → 4HF + O2; со щелочами: 2F2 + 2NaOH → 2NaF + H2O + OF2; с оксидом кремния: 2F2 + SiO2 → SiF4 + O2.
15 Бром обладает меньшей химической активностью по сравнению с фтором и хлором, но все равно довольно высокой. Он взаимодействует как с металлами: 3Br2 + 2Al → 2AlBr3, так и с неметаллами: Br2 + H2 → 2HBr, 2Br2 + Si → SiBr4. При растворении в воде образуется бромная вода, которая находит применение в органической химии.
Химические свойства йода обладают низкой химической активностью, особенно по сравнению с бромом. Он реагирует с металлами только в процессе нагревания: взаимодействие йода с железом I2 + Fe = FeI2, а Взаимодействие йода с алюминием 3I2 + 2Al = 2AlI3. С неметаллами он реагирует с водородом при нагревании I2 + H2 = 2HI — Q.
Вывод: химическая активность галогенов уменьшается от фтора к йоду, поэтому галоген с меньшим порядковым номером может вытеснять галоген с большим порядковым номером из его соединений с водородом и металлами. Например, взаимодействие хлорной воды с галогенидами 2KI + Cl2 = 2KCl + I2 и NaCl + Cl2 = 2NaCl + Cl2 2NaBr.
18 Выявление галогенид-ионов Качественные реакции на хлориды, бромиды и йодиды — образование нерастворимых соединений серебра: NaCl + AgNO 3 AgCl + NaNO 3 белый крошечный осадок NaBr + AgNO 3 AgBr + NaNO 3 желтоватый крошечный осадок NaI + AgNO 3 AgI + NaNO 3 желтый крошечный осадок
19 Галогены и здоровье Заполни таблицу: Название галогена Роль в организме Недостаток Избыток Источник
20 Фтор и здоровье (суточная норма 2-3 мг) Роль в организме обеспечивает крепость костной ткани, правильный рост скелета, волос и ногтей, повышает устойчивость зубов к кариесу и принимает участие в кроветворении, защищает от остеопороза Недостаток: кариес (повреждение зубной эмали), ослабление костей, выпадение волос Избыток: флюороз (пятнистость эмали зубов), замедление роста, деформация скелета Источники фтора Вода Морская рыба Грецкие орехи Чай
Роль хлора в организме заключается в образовании соляной кислоты, поддержании водно-электролитного баланса, выведении шлаков и углекислого газа из организма, а В расщеплении жиров. Недостаток этого вещества может проявляться мышечной слабостью, сонливостью, вялостью, ослаблением памяти, потерей аппетита, сухостью во рту, выпадением зубов и волос. Избыток хлора может привести к задержке воды в тканях, повышению кровяного давления, болям в голове и груди, диспепсическим расстройствам, сухому кашлю, слезотечению и рези в глазах.
Источники хлора:
- Свекла
- Бобовые
- Злаки
- Поваренная соль
Здоровье и бром (необходимое количество 0,5-2 мг в сутки). Роль элемента в организме заключается в регуляции нервной системы, воздействии на функции половых желез и процессы возбуждения и торможения в головном мозге. Недостаток брома может привести к бессоннице и снижению уровня роста эритроцитов в крови. Избыток элемента может вызвать кожные заболевания, нарушение работы нервной системы, апатию, сонливость и ослабление памяти. Богатые источники брома
23 Источники йода и их роль для здоровья (суточная норма мкг)
Йод играет важную роль в организме: он участвует в синтезе гормонов щитовидной железы, способствует образованию патрульных клеток в крови — фагоцитов.
Избыток йода может привести к развитию гипертиреоза — увеличению обмена веществ, учащенному пульсу и возбудимости.
Недостаток же йода может вызвать гипотиреоз — снижение функции щитовидной железы (снижение обмена веществ, понижение температуры тела, слабость), базедову болезнь и умственную отсталость.
Источники йода включают в себя кальмары, хурму, помидоры, морскую рыбу, морковь и морскую капусту.
Химический элемент с атомным номером 24 2 (по горизонтали) — железо, является металлом. Он образует соединения с металлами и неметаллами, а также окислителем в виде легколетящих ядовитых паров.
Натрий-йодид (NaI) — название химического вещества соединения. Хлор (Cl) + 2 железа(II) хлорида (FeCl3) — химическое соединение и реакция 5 (по горизонтали). Фтор (F2) + водородфторид (HF) + кислород (O2) — химическое соединение и реакция 10 (по горизонтали). Роль хлороводородной кислоты (HCl) в реакции: пероксид марганца (MnO2) + 4 клороводородной кислоты (HCl) — марганца хлорид (MnCl2) + хлор (Cl2) + 2 воды (H2O) — реакция 12 (по горизонтали). Роль брома в реакции: бром (Br2) + 2 иода (KI) — бромистый калий (KBr) + иод (I2) — реакция 13 (по горизонтали).
Галоген, являющийся при обычных условиях жидкостью 15 (по горизонтали). Природное соединение NaCl имеет состав 17 (по горизонтали). Ученый, открывший хлор 18 (по горизонтали). Цвет осадка AgI 19 (по горизонтали). Металл, нитрат которого используют для определения галогенов 1 (по вертикали).
Высшая степень окисления галогенов (кроме фтора) 2 (по вертикали).
Галоген — это элемент, чьи кристаллы имеют черно-фиолетовый цвет с металлическим блеском. У него 6 атомов в молекулах простых веществ-галогенов, и он имеет радиоактивные свойства. Также у него есть второе название — хлороводородная кислота, и его степень окисления простых веществ равна 9. Этот элемент также известен как VIIА группы.
Цвет осадка при качественном определении ионов хлора — это фиолетовый. А название соли соляной кислоты — бромид меди.
Домашнее задание: №31, упр.3,4,6,7,9,13 (стр.151). При подготовке домашнего задания предлагаю вам заглянуть на мой сайт: Там вы найдете контрольные вопросы, на которые надо обратить внимание при изучении галогенов; ссылки на дополнительные материалы о свойствах хлора и других галогенов. До встречи на сайте!
26 В исследовании использовались материалы, такие как сведения о галогенах, портрет Бернара Куртуа, фото йода, информация о роли галогенов в организме, а также картинки, фото, портреты и видео опыты, доступные на сайте files.school-collection.edu.ru.
27 Для написания работы была использована литература от следующих авторов: Ю.В.Галичкина, Занимательная химия на уроках в классах, издательство «Учитель», 2005 г., В.В.Еремин, Н.Е.Кузьменко, А.А.Дроздов "Химия-9 класс", издательство «Мир и образование», 2005 г., а также Н.Е.Кузьменко, В.В.Еремин, В.А.Попков "Начала химии".
Технологическая карта урока "Галогены"
Необходимо обновить, расширить и углубить свои знания о строении и расположении галогенов в Периодической системе химических элементов, созданной Д.И. Менделеевым. Также изучить физические и химические свойства галогенов и ознакомиться с их применением. Важно помочь учащимся осознать практическое значение галогенов в жизни людей.
25 апреля 2022 Батынкова Галина Александровна
Содержание учебного материала
Муниципальное бюджетное общеобразовательное учреждение — Великотопальская средняя общеобразовательная школа имени Героя России О.В. Ворожанина
Технологическая карта
Тема: Галогены
Класс 9
Преподаватель химии 1 категории
Батынкова Галина Александровна
2022 год
Методическое пособие для урока по теме «Галогены»
Цель урока:
Актуализировать, расширить, углубить знания о строении, положении галогенов в Периодической системе химических элементов Д.И. Менделеева. Изучить физические и химические свойства галогенов, ознакомиться с их применением. Подвести учащихся к осознанию практической значимости галогенов в жизни человека.
Задачи урока:
На уроке будет рассмотрено положение галогенов в Периодической системе химических элементов Д.И. Менделеева, а также особенности строения атомов галогенов. Ученики повторят и обобщат сведения о ковалентной неполярной химической связи и изучат физические и химические свойства галогенов.
Урок также поможет расширить кругозор учащихся о происхождении названий галогенов и их открытии, способствует дальнейшему расширению научных знаний, формированию научно-теоретического мышления, а также развитию интереса к химии и логического мышления.
Кроме того, урок будет способствовать формированию химического мировоззрения и единой картине мира, а также развитию умения учащихся работать самостоятельно и повышению мотивации к изучению химии.
Таким образом, тип урока — комбинированный, а методы будут обьяснительно-иллюстрационный и частично — поисковый.
Необходимое оборудование для проведения урока включает в себя компьютер, мультимедийный проектор, электронную презентацию и дидактический материал (Приложение 1,2).
На данном уроке будет использоваться технологическая карта.
Этапы урока будут включать в себя использование учебно-методического комплекса, а также организацию деятельности как учителя, так и учащихся.
В результате взаимодействия всех участников урока будет достигнут определенный результат.
Галогены
Халькогены (от др.-греч. hals — соль и genes — рождающий) — это химические элементы VII группы: F, Cl, Br, I, At. Они активно взаимодействуют с большинством других элементов и органических соединений.
Халькогены широко распространены в природе. Их химическая активность уменьшается от фтора к астату.

Общая характеристика элементов VIIa группы
От F до At (вверх по периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств. Уменьшается электроотрицательность, энергия ионизации, сродство к электрону.
Все элементы галогенов являются неметаллами и сильными окислителями.

- Ф — 2s 2 2p 5
- Хлор — 3s 2 3p 5
- Бром — 4s 2 4p 5
- Иод — 5s 2 5p 5
- Астат — 6s 2 6p 5
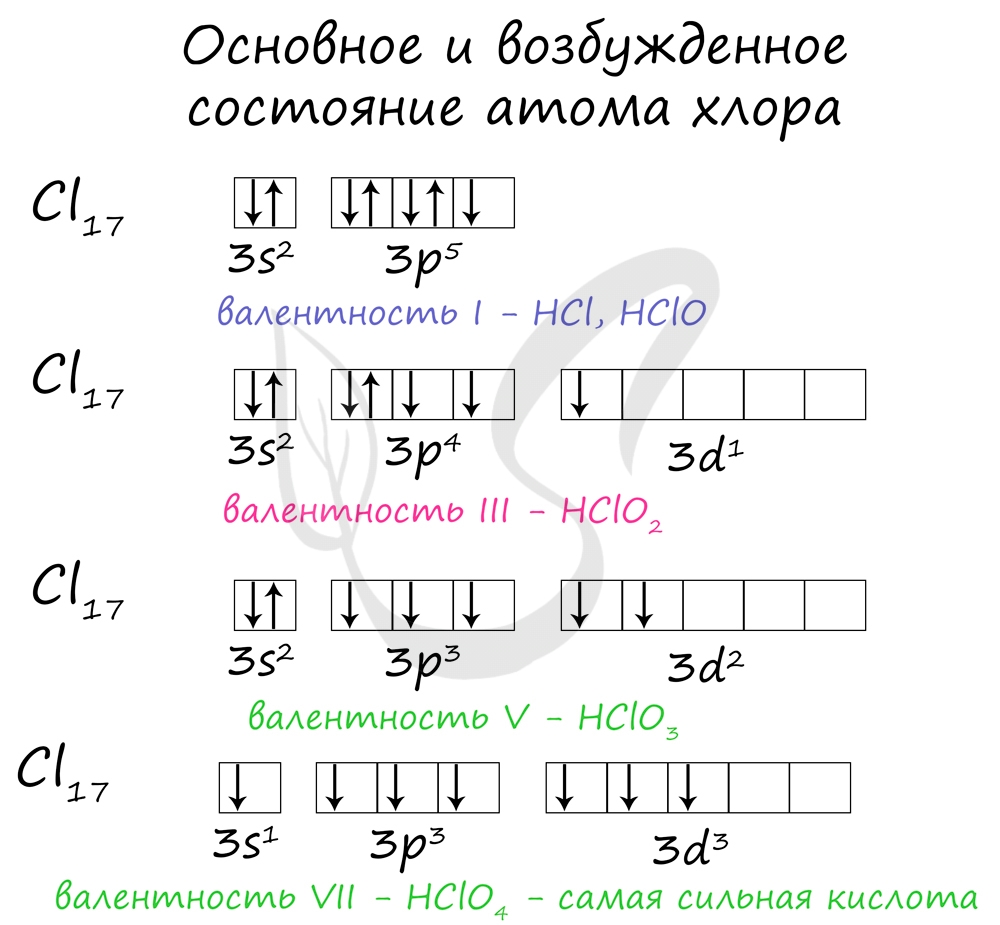
У галогенов характерны нечетные степени окисления: -1, +1, +3, +5, +7. Это связано с электронной конфигурацией атомов в возбужденном состоянии.
Природные соединения
- Галит (каменная соль) — NaCl
- Флюорит, плавиковый шпат — CaF2
- Сильвинит — NaCl*KCl
- Фторапатит — 3Ca3(PO4)2*CaF2
- Бишофит — MgCl2*6H2O
- Карналлит — KCl*MgCl2*6H2O

Простые вещества — F2, Cl2, Br2, I2
Уникальный текст о получении галогенов в чистом виде путем электролиза водных растворов и расплавов их солей. Например, в промышленности электролизом водного раствора хлорида натрия получают хлор.
Фтор был впервые получен электролизом расплава гидрофторида калия KHF2 в безводной плавиковой кислоте — HF.
Более активные галогены способны вытеснять менее активные.
Активность галогенов убывает: F → Cl → Br → I.

При опытных условиях возможно получение галогенов через следующие реакции.
Галогены обладают высокой реакционной способностью. Фтор реагирует со всеми металлами, при этом некоторые из них в присутствии фтора могут самовоспламеняться.
Хлор, подобно фтору, обладает высокой химической активностью. Он не реагирует только с кислородом, азотом и благородными газами.

Реакция фтора с водой может протекать очень энергично и имеет взрывной характер. А вот хлор реагирует с водой обратимо, образуя хлорную воду — смесь хлорноватистой и соляной кислоты. Галогены вступают в реакцию друг с другом, и чтобы определить степени окисления в получающихся соединениях, вспомните электроотрицательность — это поможет вам понять, почему так происходит.
Например, реакция фтора с бромом приводит к образованию фторида — потому что фтор более электроотрицателен, чем бром. А если взять бром и йод, то образуется йодистый бром, потому что бром более электроотрицателен, чем йод. В общем, галогены обладают интересными свойствами и способностью реагировать с другими веществами.

Обратим внимание, что активность йода значительно ниже, чем у других галогенов. Йод практически не реагирует с неметаллами, а с металлами — только при нагревании.
Cl2 + NaOH → NaCl + NaClO + H2O
Галогены могут вытеснять друг друга из солей. Более активные галогены вытесняют менее активные.
KBr + I2 ⇸ (реакция не происходит, потому что йод менее активен, чем бром)
Галогеноводороды
- HF — фтороводород (газ), фтористоводородная (плавиковая) кислота (жидкость)
- HCl — хлороводород (газ), соляная кислота (жидкость)
- HBr — бромоводород, бромоводородная кислота
- HI — йодоводород, йодоводородная кислота
- HAt — астатоводород, астатоводородная кислота
При н.у. HCl, HBr, HI — газы, хорошо растворимые в воде.
В промышленности применяют получение прямым методом: реакцией водорода с галогенами.
В лабораторных условиях галогеноводороды можно получить в реакциях обмена между галогенсодержащими солями и сильными кислотами.
HF — является слабой кислотой, HCl, HBr, HI — сильные кислоты. Металлы, стоящие в ряду напряжений до водорода, способны вытеснить водород из кислоты.

Взаимодействие галогеноводородов с щелочными, амфотерными оксидами и основаниями приводит к образованию соответствующих солей.
KOH + HCl → KCl + H2O (процесс нейтрализации)

HI выделяются в некоторых реакциях как мощные восстановители.

Обычно галогеноводороды не взаимодействуют с оксидами неметаллов. Однако важно изучить реакцию SiO2 с плавиковой кислотой.
Автор данной статьи — Юрий Сергеевич Беллевич, и она является его интеллектуальной собственностью. Любое использование информации и материалов статьи без согласия автора преследуется по закону. Для получения материалов и разрешения на использование обращайтесь к автору — Юрию Беллевичу.
Опрос на тему Галогены
Сходство водорода с галогенами
В таблице Менделеева в группе галогенов часто можно заметить наличие водорода. Этот химический элемент представлен одновременно в первой и седьмой группах. Такая особенность обусловлена уникальными свойствами водорода и его структурой.
Химическое строение водорода
Первый элемент таблицы Менделеева — это водород, у которого самый маленький атом и всего один электрон на единственном энергетическом уровне.
С одной стороны, присутствие одного электрона на внешнем энергетическом уровне делает его похожим на щелочные металлы, из-за чего он находится в первой группе. Но с другой стороны, на его первом энергетическом облаке присутствует всего один электрон из двух возможных. Это означает, что ему не хватает всего лишь одного электрона до завершения уровня, что делает его похожим на галогены.
Такая структура атома приводит к тому, что физические свойства водорода отличаются как от щелочных металлов, так и от галогенов.

Вопреки недавнему открытию, водород обладает очень низкой окислительной активностью и может принять электрон только у веществ, способных окисляться, то есть, у металлов. Ни один другой неметалл не обладает такой способностью как водород.
Природные соединения галогенов
Галогены широко распространены в природе, однако они не встречаются в виде простых веществ, а в составе солей. В отличие от первого варианта, соли не имеют резкого негативного воздействия. Многие из них используются в пищу и являются жизненно важными соединениями.
Преимущественно они образуют бинарные соли — галогениды, хотя возможны и другие варианты.
Таблица 2. Минералы, образованные галогенами

Элемент астат в природе не обнаруживается в виде минералов, и считается одним из самых редких элементов на планете, общее количество которого оценивается в 30 граммов.
Галогены — особая группа химически активных веществ

Галогены – это класс простых неорганических веществ с сходными химическими свойствами, все они являются неметаллами. Название "галоген" изначально предложено для хлора как "рождающий соль", но затем хлор стал называться хлором, а группа элементов, к которой он относится, получила название "галогены" и включает в себя фтор, хлор, бром, йод, астат и теннесин.
Первые четыре элемента широко распространены на Земле, а содержание астата оценивается учеными всего в несколько граммов. Теннесин (с атомным номером 294) был создан искусственно.
Все галогены химически активны, поэтому естественно встречаются только (за исключением йода) в минералах, морской воде и подземных рассолах.
Их свойства
Физические свойства у галогенов отличаются. Фтор и хлор существуют в виде газа. Бром является жидким и легко испаряется. Йод имеет кристаллическую твердую структуру, которая прямо переходит в газообразное состояние, минуя жидкую фазу. Астат находится в твердом состоянии.
Все галогены плохо растворяются в воде, но могут образовывать "хлорную", "йодную" и "бромную" воду, частично реагируя с водой. Они растворяются в неполярных органических растворителях. Все галогены ядовиты и имеют неприятный запах.
С точки зрения химии, галогены демонстрируют высокую активность. Они взаимодействуют с различными металлами, а также с большинством неметаллов, включая органические соединения. Активность галогенов уменьшается по мере перехода от фтора к астату. Например, фтор чаще всего реагирует с металлами и неметаллами при обычных условиях, в то время как йод для начала реакции с металлами требует повышения температуры, а с большинством неметаллов он вообще не взаимодействует. Все галогены обладают ярко выраженными окислительными свойствами, но с более сильными окислителями они сами выступают в роли восстановителей (за исключением фтора, у которого всегда степень окисления -1).
Преимущества и риски
Все галогены обладают высокой степенью токсичности. Например, пары йода, проникающие в легкие в больших количествах, могут вызвать отек легких, поражение почек и негативное воздействие на сердечно-сосудистую систему. Если не принять своевременных мер, это может привести к летальному исходу. Особенно опасны хлор и фтор. Хлор был первым химическим боевым отравляющим газом.
Воздействие фтора на кожу в течение двух секунд вызовет сильнейший ожог из-за крайней химической агрессивности вещества. Поэтому при работе с галогенами необходимо использовать средства защиты, включая противогазы.
Несмотря на их токсичность, галогены являются биогенными элементами, необходимыми для нормального функционирования человеческого организма.
Фтор необходим для формирования эмали зубов и костной ткани.
Хлор играет ключевую роль в управлении водно-солевым балансом, необходим для функционирования нервной и мышечной системы, желудочно-кишечного тракта и эритроцитов.
Недостаток брома в организме приводит к нарушениям сна, замедлению роста у детей, прерыванию беременности и снижению уровня гемоглобина.
Йод является жизненно важным для работы щитовидной железы, оказывает влияние на развитие организма и обмен веществ. Недостаток йода отрицательно сказывается на памяти и интеллекте, работе сердечно-сосудистой системы и уровне гемоглобина.
Применение

- Фтор имеет широкое применение в синтезе фторосодержащих веществ, таких как фреоны и тефлон. Он также используется в составе зубных паст и некоторых лекарственных препаратов, а также как окислитель в ракетных топливах и в производстве алюминия.
- Хлор является одним из наиболее распространенных галогенов в промышленности. Он применяется в процессе химического синтеза для получения соляной кислоты, глицерина, ПВХ и многих других веществ. Также хлор используется для обеззараживания воды и поверхностей, отбеливания тканей и бумаги, а также для производства гербицидов.
- Бром используется в аналитической химии для определения органических соединений, а В медицине в качестве успокаивающего средства и лекарства при некоторых заболеваниях.
- Бромовые соединения находят применение в органическом синтезе, нефтедобыче, ракетном топливе, в качестве инсектицидов и пестицидов, а В фотографии.
- Раствор йода в спирте — популярное антисептическое и рассасывающее средство. Соединения йода используются в качестве контрастного раствора в рентгенографии и томографии. Изотоп I-131 применяется при радиотерапии рака щитовидной железы. Йод также используется в аналитической химии и криминалистике, в производстве аккумуляторов, галогеновых ламп, газовых лазеров и ЖК-дисплеев. Иодат и иодид калия — это пищевые добавки для иодирования соли.
Санкт-Петербург, Загородный проспект, 36. Терминал ТК "Деловые линии". Сроки доставки уточняйте у менеджеров.
Слайд 8 В 1869 г Д.И.Мендеелеев
предсказал его существование и возможность открытия в будущем (как «эка-иод»)
В 1940 году Д.Корсоном, К.Маккензи и Э.Сегре (ученые из Калифорнийского университета в Беркли) впервые получили астат искусственным путем. Они облучали висмут альфа-частицами для синтеза изотопа 211At. С 1943 по 1946 год изотопы астата были обнаружены в природных радиоактивных рядах. Астат является наиболее редким элементом среди всех, обнаруженных в природе. В поверхностном слое земной коры толщиной 1,6 км содержится всего 70 мг астата.
История открытия астата

Слайд 9Существуют только в связанном состоянии

Слайд 8: Строение атомов галогенов
Увеличение заряда ядра приводит к увеличению радиуса атома, при этом количество валентных электронов остается равным 7. Уменьшается притяжение валентных электронов к ядру, что увеличивает способность отдавать электроны. Неметаллические свойства ослабевают, и окислительная способность уменьшается.

На диаграмме изображены физические характеристики чистых галогенов.
Слайд 9: Физические свойства простых веществ-галогенов
Бром Йод Хлор Астат

Графическое представление слайда
В 1825 году ученый из Франции по имени Антуан Жером Балар в процессе изучения маточных рассолов обнаружил темно-бурое вещество, которое он назвал "мурид" (от латинского слова muria, что означает "рассол"). После проверки этой информации комиссией Академии подтверждено открытие Балара, и предложено назвать вещество бромом (от "бромос" на греческом, что значит "зловонный").
Эта история рассказывает о открытии брома Антуаном Жеромом Баларом (1802-1876).
Слайд 7
В 1811 году французский химик Бернар Куртуа открыл йод, используя перегонку маточных растворов от азотнокислого кальция с серной кислотой. Чтобы другие химики могли изучать новое вещество, Б. Куртуа подарил его (правда, очень небольшое количество) фармацевтической фирме в Дижоне. В 1813 году Гей-Люссак подробно изучил этот элемент и дал ему современное название. Название "иод" происходит от греческого слова "иодэс" — "фиолетовый" (по цвету паров).
Этапы открытия йода
Бернар Куртуа (1777 – 1838 )




